Concentración máxima tolerable en una bebida de carbohidratos
Descubre qué es el glucógeno muscular y su papel vital en tu rendimiento deportivo. ¡Aprende cómo optimizar tus entrenamientos utilizando el glucógeno!
Envío gratis a partir de 30€

Información
El glucógeno muscular es un componente vital en el almacenamiento de energía en el cuerpo humano. Su formación y acumulación están estrechamente ligadas al consumo de carbohidratos, siendo fundamental en la restauración y mantenimiento de nuestros depósitos energéticos.
Diferentes estrategias como inmersión en agua fría, recuperación activa, prendas de compresión, masaje y estimulación eléctrica están siendo actualmente utilizadas con el fin de mejorar la recuperación del deportista, dependiendo su uso del tipo de actividad realizada, el tiempo hasta la próxima sesión de entrenamiento o competición, así como el equipo y personal médico disponible (1)
Entre los diferentes factores que pueden mejorar la recuperación del deportista, caben destacar el descanso y la nutrición (2), siendo esta última uno de los métodos más populares y accesibles para facilitar la restauración del rendimiento y las perturbaciones fisiológicas posteriores al ejercicio.
En una de nuestras guías comentamos como puedes mejorar tu recuperación con una proporción 3:1 como nuestro recovery Glycogen y no proporciones 2:1 o 2:2.
Las estrategias nutricionales durante la fase de recuperación tienen como principales objetivos: reposición del glucógeno muscular (3), restablecer el balance hidroelectrolítico del organismo, reparación del tejido muscular dañado y adaptaciones al ejercicio (4) y, restaurar aquellos sistemas fisiológicos alterados durante el entrenamiento/competición como el sistema hormonal (5) y/o inmunológico (6).
El glucógeno es un polímero ramificado de glucosa (hasta 55000 unidades) unidas por enlaces glucocídicos α 1:4 y α 1:6 en torno a una proteína central, la glucogenina (7).
La importancia del glucógeno muscular como determinante de la capacidad de ejercicio se reconoció por primera vez ya a finales de 1960 con la introducción de la técnica de biopsia muscular en la fisiología del ejercicio (8).
El glucógeno es mucho más que un almacén de energía (9), actuando como regulador de diferentes vías de señalización relacionadas con el fenotipo oxidativo, sensibilidad a la insulina, procesos contráctiles, degradación de proteínas y procesos autofágicos (10).
El músculo es uno de los principales reservorios de glucógeno del cuerpo humano (hasta 600g). La cantidad almacenada, sin embargo, depende de distintas variables como, lógicamente, la cantidad de masa muscular del sujeto, la forma física del mismo, la dieta, etc.
Se ha documentado que los deportistas de resistencia entrenados tienen una mayor capacidad de almacenaje de Glucógeno en el músculo esquelético, siendo esta una de las principales adaptaciones a dicho ejercicio.
a glucosa almacenada en el Glucógeno muscular es una fuente biodisponible exclusiva del propio músculo y juega un papel fundamental tanto en la regulación y señalización, como en el control metabólico de las células musculares.
Aproximadamente, se estima que la cantidad de Glucógeno Hepático es de en torno a los 80-100 g, si bien esto difiere entre sujetos. La importancia del este almacén radica en su capacidad para “enviar glucosa” a la sangre y regular, por lo tanto, la glucemia.
Esto sucede gracias a la Enzima Glucosa-6-Fosfatasa que no existe, por ejemplo, en el músculo esquelético. Además, hay que añadir que, tal y como comentamos en esta guía, la resíntesis de Glucógeno Hepático está relacionada con la disponibilidad de Fructosa, algo a tener muy en cuenta a la hora de recuperar los niveles de Glucógeno tras el ejercicio o previo al mismo.
Por ello, es necesario tanto maltodextrina como fructosa en un recuperador óptimo, como nuestro Recovery GLYCOGEN. (11)
Recientes descubrimientos hablan de una cantidad significativa, aunque 100 veces menor al resto de almacenes, ubicada en el cerebro. En concreto, en los astrocitos, células gliales que cumplen una amplia gama de funciones relacionadas con el soporte a las neuronas y el sistema nervioso.
Existen estudios que relacionan este contenido en Glucógeno con la posible fatiga central inducida por el ejercicio que ya mencionamos en esta guía. Sin duda, se abre un nuevo campo de investigación que nos puede ayudar a determinar los verdaderos factores limitantes del rendimiento. (12)
En los riñones, así como en el músculo liso y cardíaco, la cantidad de glucógeno es mínima, por lo que la significancia es también muy baja.
Así mismo, también encontramos pequeñas cantidades de glucógeno en los glóbulos rojos y blancos, y la clásica cantidad de glucosa (no glucógeno) disponible en la sangre (glucemia), que aproximadamente son 5g, cantidad que diferirá dependiendo de muchos factores (la dieta el primero). (13)

Durante un ejercicio al 50% del VO2máx, el ratio aproximado de utilización del Glucógeno es de 0,6 mmol de unidades de glucosil/kg de músculo seco/minuto, mientras que si la intensidad sube a un 100%, dicho ratio asciende hasta los 3,6 mmol/kg.dw/min. Así mismo, durante un esfuerzo máximo, su utilización puede alcanzar los 30-50 mmol/kg.dw/min. (14)
Como sabemos, el glucógeno muscular no solo tiene que ser recuperar a nivel muscular, sino que también tiene que ser recuperado a nivel hepático para una óptima recuperación al 100%, y aquí es donde entra en juego nuestro Recovery con un ratio 2:1 en carbohidratos (maltodextrina: fructosa) y un 3:1 total (carbohidratos: proteínas).
A nivel relativo y de forma general, representa una cantidad del 5-15% del total del glucógeno muscular. Sin embargo, dependiendo del tipo de fibras musculares, cambia su porcentaje.
Se encuentra, exactamente, en la parte más externa de la célula, justo debajo de la membrana celular, y entre los filamentos contráctiles. Su función parece estar relacionada, principalmente, con funciones reguladoras y energéticas locales, algo que no es difícil de entender si atendemos a la multitud de procesos biológicos necesarios de abastecer con energía que suceden en torno a la membrana celular. (15,16)
Su utilización durante el ejercicio varía entre fibras y músculos. En los brazos (tríceps braquial), su depleción tras 1 h de ejercicio al máximo posible es cercana al 80% en las tipo I y un 60% en las tipo II, mientras que en las piernas (vastus lateralis), un 60% en las fibras tipo I y una bajada casi insignificativa en las tipo II.
De forma relativa supone el 75% del glucógeno muscular, representando el mayor número cuantitativo entre las 3 localizaciones. Dependiendo del tipo de fibra muscular, se almacena en mayor cantidad en las de tipo II (84%) que en las tipo I (77%).
Su localización, ubicada entre las miofibrillas, hace que su biodisponibilidad energética sea muy alta. De hecho, se sitúa muy cerca de las mitocondrias y del retículo sarcoplasmático. En este sentido, parece cumplir una función energética prioritaria que es “constante” y eficientemente regulada.
Tras 1 h de ejercicio de brazos y piernas, su depleción varía, también, entre grupos musculares, si bien no parece observarse una disminución muy diferente según el tipo de fibras musculares:
Representa un bajo porcentaje relativo del total (5-15%). En las fibras tipo I rellena un 12% del glucógeno total, mientras que en las tipo II una cantidad menor (8%).
Su localización es clave. Se ubica dentro las miofibrillas dentro de los miofilamentos contráctiles y, en concreto, en torno a la banda I del sarcómero. Tiene, por lo tanto, una distribución muy cercana a las estructuras miofibrilares relacionadas con el proceso de contracción.
Tras 1 h de esquí de fondo al máximo (contrarreloj de 20 km) en esquiadores profesionales, el glucógeno Intramiofibrilar de los brazos (triceps brachii) se deplecionó en un 90% en las fibras tipo I y en un 17% en las fibras tipo II. En las piernas (vastus lateralis), sin embargo, en un 70% en las tipo I y se mostró un curioso incremento en las fibras tipo II.
La restauración de las reservas endógenas de CHO es crucial para determinar el tiempo requerido en la recuperación (19), por tanto, uno de los enfoques nutricionales principales en el deportista, tras el ejercicio, es la reposición del glucógeno muscular y hepático mediante la ingestión de CHO. (20)
El proceso de resíntesis de glucógeno muscular, comienza inmediatamente después del ejercicio, siendo mucho más rápido durante las primeras 5-6 h de recuperación (21). Uno de los principales estímulos que llevan a una mayor síntesis de glucógeno se encuentra en su propia depleción. (22)
Sin embargo, el mayor determinante de la resíntesis de glucógeno muscular y hepático se encuentra en una elevada ingesta de CHO alrededor de 1-1,5 gramos/kg de peso post esfuerzo inmediato y durante la recuperación, aumentando la resíntesis a 5-10 mmol/Kg de peso seco/h. (23)
La estrategia óptima de ingesta de CHO para maximizar las reservas de glucógeno varía mucho y depende de una serie de factores que incluyen, principalmente, la cantidad, el momento y el tipo de CHO(ratio 2:1) ingeridos durante la recuperación (24).
Cuando hablamos de cómo se almacena el glucógeno, hablamos del momento de la ingesta de carbohidratos, esencial para la restauración de nuestros depósitos de energía.
Para comprender la importancia del momento de la ingesta de CHO, es necesario entender cuáles son las dos fases de su resíntesis. Así, diferentes estudios han indicado que la resíntesis de glucógeno después del ejercicio se produce siguiendo un patrón bifásico (25).
Inicialmente, hay un aumento rápido en la tasa de resíntesis, independiente de las concentraciones de insulina y que dura aproximadamente 30-60 minutos después del ejercicio; esto respalda la alta síntesis de glucógeno en los 60 minutos inmediatos a la finalización del ejercicio. (26)
Por ello, desde FANTÉ te recomendamos unos modos de uso innovadores con respecto a los recoverys actuales, diferenciando tiempo y dosis por peso del atleta, jamás visto en ningún modo de uso hasta la fecha.
En esta fase se puede observar un aumento de la translocación de la proteína transportadora de glucosa (GLUT-4), debido a un aumento de las concentraciones de calcio a nivel del sarcoplasma del rabdomiocito (consecuencia, a su vez, de los múltiples potenciales de acción que tienen lugar durante el esfuerzo) (27), de hasta dos veces, disminuyendo gradualmente hasta alcanzar los niveles previos al ejercicio a las 2 h después de su finalización. (28)
En cuanto al glucógeno hepático, este es rápidamente restaurado durante la ingesta de alimentos post ejercicio con un contenido 0,2 a 0,5 gramos fructosa/kg peso, ayudando al mantenimiento de una normoglucemia o bien, cuando la ingesta de CHO no se realiza post ejercicio, vía gluconeogénica a partir de lactato. (29)
A la luz de lo descrito anteriormente, parece existir una potencial ventana de oportunidad post ejercicio que los deportistas deberían aprovechar para larecuperación del glucógeno muscular (30).
De hecho, cuando se compara la ingestión inmediata de CHO respecto a una ingesta hasta 2 horas después del ejercicio, da lugar a concentraciones un 45% más bajas de glucógeno muscular (31).
En el contexto de la recuperación de ejercicio exhaustivo, se sabe que la ingesta de 6-12 g/Kg es suficiente para restaurar las reservas endógenas de glucógeno cuando el tiempo de recuperación es ≥ 24 h. (32, 33)
Sin embargo, cuando el tiempo de recuperación es limitado (< 8 h), se hacen necesarias estrategias específicas dirigidas a acelerar la resíntesis de glucógeno (26).
De forma similar a los efectos del índice glucémico de los alimentos durante periodos más largos (es decir, 24 h), la frecuencia de ingesta de CHO no parece influir en la resíntesis de glucógeno muscular, sin embargo, cuando el tiempo de recuperación es limitado, la frecuencia a la que se ingiere el CHO puede tener influencia.
Esto ha quedado de manifiesto en estudios que han mostrado que una ingesta de CHO ocurrida en intervalos de 15-30 minutos, la tasa de resíntesis de glucógeno muscular es aproximadamente un 40% más alta que cuando se suministra cada dos horas (34, 35, 36).
En relación con la cantidad de CHO recomendable para la reposición de glucógeno, van Loon et al. (12) mostraron como la ingesta de 1,2 g/Kg/hora de CHO resultó en una resíntesis de glucógeno un 150% mayor (de 17 a 45 mmol/Kg dm/h) en relación con una dosis más baja de 0,8 g/Kg/hora (12).
Buscando la cantidad óptima al respecto, Howarth et al. (2009), (37) mostraron como la ingestión de 1,6 g/ Kg/hora no estimulaba más la resíntesis de glucógeno, considerando que la cantidad de CHO post ejercicio recomendada rondará 1,0-1,5 g/Kg/hora máximo dentro de la primera hora del cese de ejercicio y continuará con una ingesta de 1,0-1,5 g/Kg/h cada 4-6 horas o hasta reanudar las comidas habituales (38).
Un factor importante que determina la resíntesis de glucógeno muscular es la captación de glucosa mediada por la insulina en las células musculares.
La ingesta de CHO de moderado o alto índice glucémico (IG) es una buena opción para conseguir una restauración del glucógeno, en parte, por dar una rápida disponibilidad de glucosa y respuesta a la insulina (39).
Cuando se compara fructosa con glucosa o sacarosa, se observa que la respuesta insulinémica es menor en la primera, lo que se atribuye a un uso mayor de este monosacárido en la resíntesis de glucógeno hepático (26, 40).
Por otro lado, glucosa y sacarosa parecen tener un efecto similar en la resíntesis del glucógeno muscular, como fue demostrado recientemente en un estudio, donde se mostró como la ingesta de 1,2 g/Kg/h de glucosa, glucosa + fructosa o glucosa + sacarosa durante la recuperación ocasionaban tasas similares de resíntesis glucógeno muscular (41).
En relación con esto, se recomienda ingerir una mezcla de glucosa + fructosa en ratio 2:1 que proporcione una dosis óptima de CHO para la restauración efectiva del glucógeno hepático y muscular. (26)
La ingestión de formas líquidas o sólidas de CHO parecen ser igualmente efectivas en la restauración del glucógeno muscular, por lo que deberá primar la preferencia individual del deportista (42). Sin embargo, y como apunta Ranchordas (2017) (30), desde una perspectiva práctica sería interesante que los deportistas tengan acceso a mezclas de alimentos tantos sólidos como líquidos, para así evitar dichos problemas.
Diferentes factores nutricionales están siendo estudiados con el fin de potenciar la resíntesis de glucógeno junto con la ingesta de CHO. En este sentido, diferentes estudios han mostrado que la ingesta simultánea de CHO y proteínas puede ser beneficiosa para la resíntesis de glucógeno. (37)
Esto se debe a que la ingesta de proteína eleva la secreción de insulina por el páncreas, estimulando la resíntesis de glucógeno.
El tipo de proteína parece influir en la secreción de insulina. Así, la proteína hidrolizada (isolate) ha mostrado tener un mayor efecto sobre la secreción de insulina que una proteína intacta, lo que se relaciona con su tasa acelerada de digestión y absorción (43, 44).
Además, la proteína de suero parece ser un mayor estimulador de la insulina que la caseína, debido posiblemente a su mayor contenido en leucina (45). Por lo que nosotros utilizamos isolate protein de suero de leche antes que otro tipo en nuestro recovery GLYCOGEN.
¿Entonces carbohidratos y proteínas 3:1?
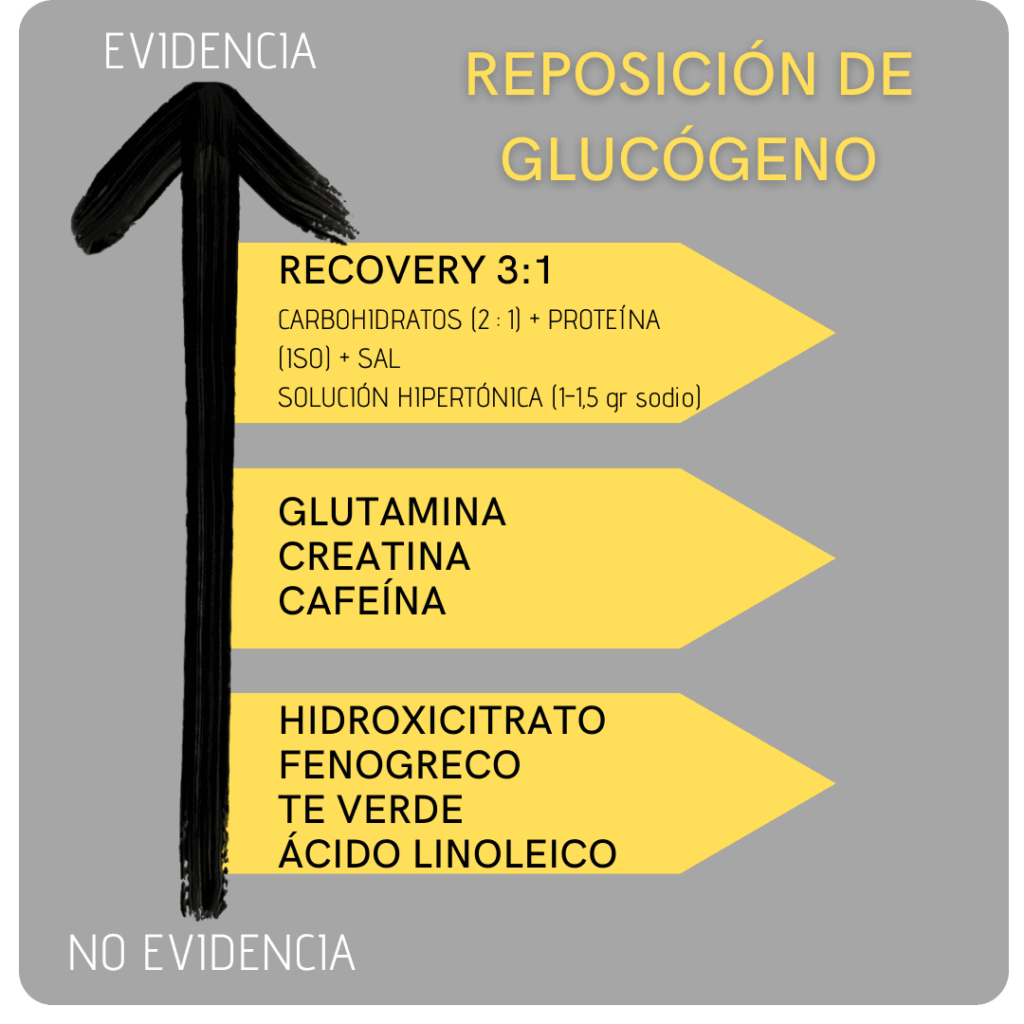
La glutamina es un aminoácido condicionalmente esencial muy utilizado en nutrición deportiva, especialmente por su papel inmunomodulador. No obstante, la glutamina cumple varias otras funciones biológicas, como la proliferación celular, la producción de energía, la glucogénesis, la amortiguación del amoníaco, entre otras.
Otra posible propiedad antifatiga de la glutamina es prevenir la deshidratación. La glutamina es transportada a través del borde en cepillo intestinal por un sistema dependiente de sodio, lo que promueve una absorción más rápida de líquidos y electrolitos en el intestino.
Por lo tanto, la inclusión de glutamina en las soluciones de rehidratación podría aumentar la absorción de sodio y el flujo de agua.
Cuando nosotros ingerimos un recovery este tiene que tener un buen aporte de carbohidratos acordes a nuestro peso, el tipo de carbohidratos 2:1, proteína y en una cantidad adecuada, y una cantidad adecuada de minerales específicos con el objetivo de reponer lo que hayamos gastado.
La cantidad es fundamental no solo para reponer sales, sino que al tener una cantidad alta y ser una bebida hipertónica favorece la entrada de soluto(cho) a la célula más rápido que una bebida isotónica(monodosis) o hipotónica.
Por lo que en FANTÉ optamos a que el recovery sea hipertónica de acuerdo a la actual evidencia científica, añadiendo 0,8 GR de sodio por toma para pesos de hasta 50 kg y 1,5 GR de sodio para >90 kg por dosis.
¡Recuerda! Al ser hipotónica resintetizas muy rápido el glucógeno, pero no te hidrata, por lo que te aconsejamos prepararte otro bidón con agua e ir bebiendo también de ese y no solo única y exclusivamente de Fanté GLYCOGEN
La creatina también ha sido estudiada en su acción sinérgica para la resíntesis de glucógeno. De esta forma, estudios han mostrado como la ingesta de monohidrato de creatina aumenta la expresión de genes envueltos en diferentes actividades, entre las que se encuentra la resíntesis de glucógeno, lo que se sugiere está mediado por el efecto osmótico de esta ayuda ergogénica (46).
Robert et al. (2016) (47) observaron un incremento en el almacenamiento de glucógeno post ejercicio seguido de la ingesta de la suplementación de creatina (20 g/día) junto con una dieta elevada en CHO.
Esto fue más evidente en las 24 h después del ejercicio y fue mantenido durante 6 días de recuperación post ejercicio con una dieta elevada en CHO.
Es importante, considerar las ganancias del 1-2% de peso corporal que pueden deberse al uso de creatina, lo que puede interferir en algunos deportes, donde la ganancia de peso puede perjudicar el rendimiento (ej. salto de altura) (38).
Otros de los nutrientes estudiados al respecto es la cafeína. Así, una investigación observó que la ingesta de 8 mg/Kg de cafeína junto con CHO (1 g/Kg/h) resultó en una sustancial elevación del contenido de glucógeno durante 4 h de recuperación post ejercicio (48).
Sin embargo, se debe tener en cuenta la posible interferencia de esa elevada cantidad de cafeína en el sueño del deportista. Además, otros estudios similares no han encontrado diferencia en el contenido de glucógeno (49).
Una reciente revisión sistemática ha analizado como los diferentes compuestos contenidos en el café puede afectar a la resíntesis del glucógeno muscular, mostrando como alguno de esos compuestos pueden activar diferentes vías moleculares conducentes a un aumento de la síntesis de glucógeno muscular, lo que hace concluir a los autores la posibilidad del café como una opción en la recuperación del deportista.
Todavía se debe estudiar más.
Por último, se debe tener en cuenta que el alcohol puede interferir la repleción de glucógeno.
En relación con esto, Burke et al., (2003) (50) mostraron como la ingesta de alcohol (aproximadamente 120 g) podía interferir indirectamente sobre el almacenamiento de glucógeno en la recuperación, desplazando a la ingesta de CHO.
Sin embargo, los efectos directos aún no han sido aclarados.
¿Te podemos ayudar?
Descubre qué es el glucógeno muscular y su papel vital en tu rendimiento deportivo. ¡Aprende cómo optimizar tus entrenamientos utilizando el glucógeno!
Descubre qué es el glucógeno muscular y su papel vital en tu rendimiento deportivo. ¡Aprende cómo optimizar tus entrenamientos utilizando el glucógeno!
Descubre qué es el glucógeno muscular y su papel vital en tu rendimiento deportivo. ¡Aprende cómo optimizar tus entrenamientos utilizando el glucógeno!
Descubre qué es el glucógeno muscular y su papel vital en tu rendimiento deportivo. ¡Aprende cómo optimizar tus entrenamientos utilizando el glucógeno!

Envío gratuito
A partir de 30 €

Entrega Rápida
Entrega es de 1 día hábil

Pago Seguro
Con tarjeta y bizum

Alta calidad
Todos los productos
¡No te pierdas nada!
¡Únete a nuestra comunidad y mantente al día con lo último en nutrición deportiva y consigue 5€ dto en tu primera compra!